新冠病毒有四种结构蛋白:刺突蛋白、膜蛋白、包膜蛋白和核衣壳蛋白。刺突蛋白从冠状病毒中部伸出,附着在细胞的 ACE2 受体上,启动细胞进入、复制和感染的过程。刺突蛋白的两个主要部分是 S1 和 S2 亚基。S1 具有受体结合域。
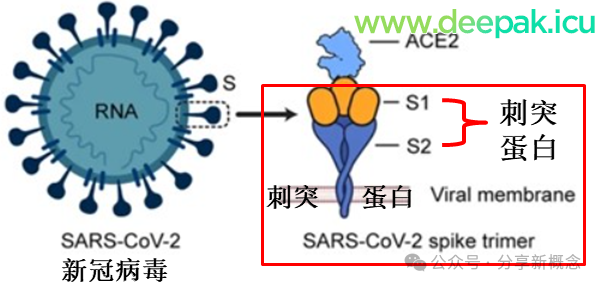
新冠疫苗接种旨在以中和抗体的形式产生针对刺突蛋白的免疫反应,以便在未来的新冠病毒暴露中可以预防新冠。
游走刺突蛋白散布到血液中
刺突蛋白是一种跨膜蛋白,锚定在病毒膜上。锚定在细胞上至关重要,一旦刺突蛋白或其以肽形式存在的片段溶解或漂浮在血液中,漂浮在血液中的刺突蛋白无论到达何处都会引起免疫反应。
它会在动脉和毛细血管中诱发炎症和血栓形成。血栓形成是级联反应,只需要一个很小的血栓就会形成一个大血栓。一旦血栓阻塞某个器官的血液流动,可能会发生致命的 心脏病发作、肺栓塞和中风。
细胞破裂,刺突蛋白释放到血液中
- 细胞破裂:感染细胞最终可能因为病毒的复制和积累而死亡,过程称为细胞裂解。这会导致细胞膜破裂,释放出包含病毒颗粒和刺突蛋白在内的细胞内容物到血液中。
- 刺突蛋白的释放:破裂的细胞不仅释放完整的病毒,还可能释放分离的刺突蛋白到血液中。这些刺突蛋白可以引发免疫反应和炎症。
细胞外囊泡让刺突蛋白进入血液
细胞外囊泡(括外泌体)可能是刺突蛋白进入血液而不分解的另一种方式。这也是在外泌体和免疫细胞中测试到刺突蛋白。
细胞外囊泡通过包裹和释放病毒产物(如刺突蛋白)是一种属于细胞层面的抵御病毒感染的机制。这些囊泡携带刺突蛋白等病毒产物可被其他免疫细胞(如树突状细胞、T细胞、B细胞等)识别和摄取。当T细胞和B细胞摄取细胞外囊泡中的刺突蛋白时,可在细胞内检测到这些蛋白质。进而引发免疫应答,以抑制或清除病毒感染。
一些病毒可采用细胞外囊泡来传播并隐藏于宿主体内,从而避免免疫系统的清除。刺突蛋白可通过细胞外囊泡释放来增加其在体内的稳定性,并避免被体内蛋白酶或其他降解酶降解过程。可能是一种病毒逃避免疫系统攻击的策略之一。

2023年1月07日,中科院上海药物在Cell Discovery发表题为《 细胞外囊泡介导 SARS-CoV-2 的抗体抗性传播》。研究发现囊泡不仅可携带大量肿胀受损的细胞器,且可携带大量的病毒颗粒,实验进一步证实该囊泡中的病毒为活病毒粒子,具有感染能力。
疫苗所产生的可溶性刺突蛋白具生物活性,由于缺乏跨膜区域和细胞内尾部,无法锚定在细胞膜上,没有停留该在的地方,脱离细胞在身体内游走,散布到全身,便会引起副作用。引发非特异性免疫反应、自身免疫反应、血管内皮损伤、心脏和其他器官的潜在影响以及长期免疫反应。
胞外囊泡(如外泌体)病毒存储库
在感染后或接种疫苗后,某些细胞或组织可能长期保留病毒RNA、蛋白质或病毒颗粒。这些储存器是淋巴结、肺、肠道、神经系统等。
即使病毒不再进行大量复制,储存器中的病毒或病毒组可被持续释放,可能通过细胞外囊泡(如外泌体)含刺突蛋白,可在血液中传播,将刺突蛋白传递到身体的其他部位。
这些囊泡保护刺突蛋白免受宿主蛋白酶的分解,允许其在体内长时间存在并发挥生物活性。T 细胞可与外泌体中的刺突蛋白相互作用并引起炎症 。辉瑞注射后证实外泌体内存在免疫原性刺突蛋白。
疫苗的刺突蛋白会在血液中停留
哈佛医学院和哈佛大学教授戴维·R·沃尔特一项研究结果发现疫苗接种者的血浆中存在循环新冠病毒疫苗抗原。 这项研究作为刺突蛋白进入血液循环的早期证据。

这项研究于2021年5 月发表在《临床传染病》杂志上, 13 名接种两剂 mRNA 疫苗的医护人员的血浆。有11人体在注射后第一天,就检测到极低浓度的 S1(刺突蛋白的亚基),而在13人中有3人体内检测到完全刺突蛋白。
疫苗60天后 体内仍有刺突蛋白
另一项由斯坦福研究发现,打疫苗后60天,人体内仍有刺突蛋白残留。
2022年3月美国斯坦福大学病理学等研究机构在《细胞》杂志上发报告,提供一份有关疫苗在人体停留时间的初步数据。
7名受试者都接种过第二剂辉瑞或莫德纳疫苗。试验结果发现,从接种疫苗后的第7天起,直到第60天,都能在淋巴(淋巴结生发中心-GC,B细胞活跃产生抗体的区域,疫苗成分残留在此可能会抑制免疫细胞,导致自身免疫性疾病。)结部位都可以检测到刺突蛋白残留。
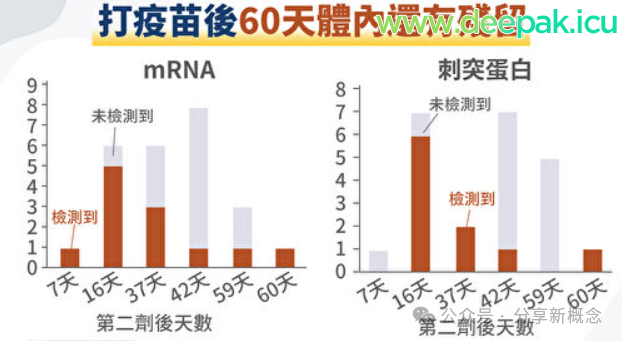
因实验只做2个月,可得知接种疫苗后,疫苗会在人体淋巴结的重要功能部位停留至少2个月(实验时间)这或许也是部分人的新冠疫苗不良反应可能会持续好几个月的原因。

可溶性刺突蛋白与病毒的刺突蛋白之间区别如下:
-
物理状态: -
可溶性刺突蛋白:在溶液中独立存在,不嵌入任何膜结构中。这种蛋白经过修饰,可以在体外系统中保持稳定并且具有功能性。 -
病毒的刺突蛋白:嵌入在病毒包膜上,是新冠病毒表面一个关键结构。它通过跨膜区域固定在病毒包膜上。
-
-
结构和组成: -
可溶性刺突蛋白:通常缺乏跨膜区域和细胞内尾部。它包含刺突蛋白的外部结构域,如受体结合域(RBD),但没有膜锚定部分。 -
病毒的刺突蛋白:具有完整结构,包括跨膜区域和细胞内尾部,这些部分使刺突蛋白固定在病毒包膜上。
-
-
功能和用途:
-
可溶性刺突蛋白:主要用于疫苗开发、研究和诊断。能够模拟病毒的刺突蛋白结构,诱导免疫反应,但不能引发感染。 -
病毒的刺突蛋白:在病毒入侵宿主细胞的过程中起关键作用。它与宿主细胞表面的受体(如ACE2)结合,介导病毒进入细胞。
-
-
生产和表达系统:
-
可溶性刺突蛋白:通过基因工程技术在表达系统(如细菌、酵母或哺乳动物细胞)中生产。去除跨膜区域和其他修饰,使其在体外溶液中保持稳定。 -
病毒的刺突蛋白:在其生命周期过程中在感染宿主细胞内天然表达和组装。
-
副作用
疫苗接种者的免疫反应或其他生物机制使得刺突蛋白保持完整。刺突蛋白不被分解,这些反应会影响刺突蛋白的处理和清除方式。
刺突蛋白更稳定且不易被宿主蛋白酶分解,可带来增强和持久的免疫反应、更高效的疫苗效力,但也可能引发潜在副作用和病毒变异压力。
副作用包括局部炎症和长期免疫反应。更稳定的刺突蛋白可能施加选择压力,使病毒产生变异以逃避免疫反应。这可能会导致新变异株的出现,从而影响疫苗的有效性。
2021年6月21日,马龙在其推特上引用沙克研究所一项研究指刺突蛋白具细胞毒性。这种蛋白质破坏细胞,证实新冠主要是一种血管疾病。
刺突蛋白及其 S1 亚基如何造成损害。它们可以协同作用并产生四种结果:炎症、血栓形成或凝块形成、自身免疫和淀粉样蛋白形成。
任何外来蛋白质进入体内都可能引发炎症。这就是为什么刺突蛋白的 S1 亚基或较短片段足以造成损害的原因。
S1 蛋白可在感染和接种疫苗后长达 15个月内持续存在于CD16+ 单核细胞中,从而诱发慢性炎症。这解释长新冠综合征的症状。
S1 蛋白含有肝素结合位点,可吸引淀粉样蛋白,从而引发淀粉样蛋白聚集。淀粉样蛋白的形成会导致神经退化,如帕金森病、阿尔茨海默病和额叶痴呆症。
刺突蛋白和肽中的蛋白质序列与人类蛋白质相似,就会发生分相似性。病毒蛋白产生的抗体也可能攻击宿主蛋白质。导致多种自身免疫性疾病,如免疫性血小板减少症(血小板计数低)自身免疫性肝病、格林-巴利综合征、IgA 肾病、类风湿性关节炎和系统性红斑狼疮。《分子相似性,理解新冠抗体是双刃剑,引发自体免疫疾病》
刺突蛋白会损害DNA损伤修复,导致抗体无效,并破坏导致癌症的BRCA1和53BP1 等肿瘤抑制基因。BRCA1 损伤与乳腺癌、卵巢癌和前列腺癌有关。53BP1 在肿瘤组织中的功能丧失与人类恶性肿瘤的发生、进展及不良预后有关。
新冠病毒的致病部分是刺突蛋白,它存在于 新冠感染和疫苗注射剂中。新冠可以预防和早期治疗,不要重复感染病毒;一旦接种疫苗,就无法控制刺突蛋白。